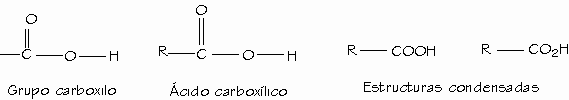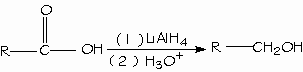Qué son:
Se caracterizan por tener el grupo "carboxilo" -COOH en el extremo de la cadena.
Cómo se nombran:
 |
- Se nombran anteponiendo la palabra "ácido" al nombre del hidrocarburo del que proceden y con la terminación "-oico".
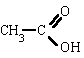 |
| ácido etanoico |
- Son numerosos los ácidos dicarboxílicos, que se nombran con la terminación "-dioico"
| ácido propanodioico |
- Con frecuencia se sigue utilizando el nombre tradicional, aceptado por la IUPAC, para muchos de ellos, fíjate en los ejemplos.
- Cuando los grupos carboxílicos se encuentran en las cadenas laterales, se nombran utilizando el prefijo "carboxi-" y con un número localizador de esa función. Aunque en el caso de que haya muchos grupos ácidos también se puede nombrar el compuesto posponiendo la palabra "tricarboxílico", "tetracarboxílico", etc., al hidrocarburo del que proceden.
| ácido 2-carboxipentanodioico o ácido 1,1,3-propanotricarboxílico |
Si nos dan la fórmula:
Coloca los localizadores desde el carbono del carboxilo. Después de la palabra ácido escribe el nombre del hidrocarburo terminado en -oico.
Si nos dan el nombre:
Sobre el esqueleto de carbonos sitúa el carboxilo en un extremo, y los radicales o insaturaciones en el localizador correspondiente. Completa después los hidrógenos.
Ejemplos:
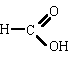 |
ác. metanoico
(ác. fórmico) |
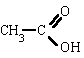 |
ác. etanoico
(ác. acético) |
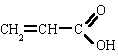 | ác. propenoico |
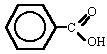 |
ác. benceno-carboxílico
(ác. benzoico) |
ác. propanodioico
(ác. malónico) | |
1,1,3-propanotricarboxílico
|
Propiedades físicas y químicas:
Marco teórico: Los compuestos que contienen al grupo carboxilo son ácidos y se llaman ácidos carboxílicos.
Propiedades físicas:
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes. Los de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero con de hidrógeno.
Puntos de ebullición.
Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. La presencia de dobles enlaces (especialmente dobles enlaces cis) en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusión más bajo.
Los puntos de fusión de los ácidos dicarboxílicos son muy altos. Teniendo dos carboxilos por molécula , las fuerzas de los puentes de hidrógeno son especialmente en estos diácidos: se necesita una alta temperatura para romper la red de puentes de hidrógeno en el cristal y fundir el diácido.
Puntos de fusión.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar. Así, los puentes de hidrógeno de dímero cíclico no se rompen cuando se disuelve el ácido en un solvente polar.
Medición de la acidez
Un ácido carboxílico se puede disociar en agua para dar un protón y un ión carboxilato. La constante de equilibrio Ka para esta reacción se llama constante de acidez. El pKa de un ácido es el logaritmo negativo de Ka, y normalmente se usa al pKa como indicación de la acidez relativa de diferente ácidos.
Propiedades químicas:
Aunque los ácidos carboxílicos contienen también al grupo carbonilo, sus reacciones son muy diferentes de las de las cetonas y los aldehídos. Las cetonas y los aldehídos reaccionan normalmente por adición nucleofílica del grupo carbonilo, pero los ácidos carboxílicos y sus derivados reaccionan principalmente por sustitución nucleofílica de acilo, donde un nucleófilo sustituye a otro en el átomo de carbono del acilo (C=O).
Formación de hidrólisis de nitrilos.
Los mejores reactivos para convertir los ácidos carboxílicos en cloruros de ácido son el cloruro de tionilo (SOCl2) y el cloruro de oxalilo (COCl)2, porque forman subproductos gaseosos que no contaminan al producto. El cloruro de oxalilo es muy fácil de emplear porque hierve a 62ºC y se evapora de la mezcla de reacción.
Síntesis y empleo de cloruros de ácido.
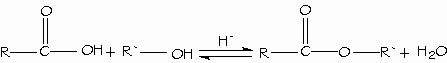
Los ácidos carboxílicos se convierten directamente en ésteres mediante la esterificación de Fischer, al reaccionar con un alcohol con catálisis ácida.
Condensación de los ácidos con los alcoholes. Esterificación de Fischer.
El hidruro de litio y aluminio (LiAlH4) reduce los ácidos carboxílicos para formar alcoholes primarios. El aldehído es un intermediario en esta reacción, pero no se puede ailar porque se reduce con mayor facilidad que el ácido original.


| Propiedades de los ácidos carboxílicos y sus derivados: | ||||
Los ácidos carboxílicos son compuestos caracterizados por la presencia del grupo carboxilo (-COOH) unido a un grupo alquilo o arilo. Cuando la cadena carbonada presenta un solo grupo carboxilo, los ácidos se llaman monocarboxilicos o ácidos grasos, se les denomina así ya que se obtienen por hidrólisis de las grasas. |
| |||
| El primer miembro de la serie alifática de los ácidos carboxílicos es el ácido metanóico o ácido fórmico, este ácido se encuentra en la naturaleza segregado por las hormigas al morder. | |||
El primer miembro del grupo aromático es el fenilmetanóico o ácido benzóico. Cuando la cadena carbonada presenta dos grupos carboxilo, los ácidos se llaman dicarboxílicos, siendo el primer miembro de la serie alifática el 1, 2 etanodíoco o ácido oxálico. |
| |||
Propiedades Físicas: | ||||
| Solubilidad: El grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la molécula de agua. La presencia de dos átomos de oxígeno en el grupo carboxilo hace posible que dos moléculas de ácido se unan entre sí por puente de hidrógeno doble, formando un dímero cíclico. | |||
Esto hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos completamente solubles en agua. La solubilidad disminuye a medida que aumenta el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua. |
| |||
En los ácidos aromáticos monocarboxílicos, la relación carbono-carbono es de 6:1 lo que provoca que la solubilidad se vea disminuida con respecto a los ácidos monocarboxílicos alifáticos. | ||||
Vídeos:
Conceptos:
- condensación: reacción química intramolecular de un compuesto orgánico.
- Compuestos: Los compuestos son sustancias que resultan de la unión química de dos o mas elementos.
- Oxidantes: Los materiales oxidantes son líquidos o sólidos que fácilmente liberan oxígeno u otra sustancia (como bromo, cloro o fluoruro). También incluyen materiales que reaccionan químicamente para oxidar materiales combustibles (abrasivo) significa que el oxígeno se combina químicamente con el otro material de manera que aumenta la posibilidad de fuego o de explosión.
- El dímero: es un producto de degradación de la fibrina, su presencia indica un proceso de fibrinolisis posterior a una trombosis.
- Insolubles: son aquellos elementos que no se pueden disolver en una ecuación
- Solubles: son aquellos elementos que se pueden desvanecer (agua)
- Alifáticos: De cada uno de los compuestos orgánicos de cadenas abiertas de átomos de carbono. Entre ellos se incluyen parafinas, olefinas y acetilenos.
- Hidrolisos: Descomposición de sustancias orgánicas e inorgánicas complejas en otras más sencillas por acción de agua
- Catálisis: Se refiere a la aceleración de la tasa de un reacción química mediante una sustancia, llamada catalizador, que no es modificada por la reacción.
- Aldehídos: caracterizan por tener un grupo "carbonilo" C=O, en un carbono primario.
webgrafia:
http://www.rena.edu.ve/cuartaEtapa/quimica/Tema13.html
http://www.alonsoformula.com/organica/acidos_carboxilicos.htm
http://www.youtube.com/watch?v=QUChrybrj7g&feature=related
http://www.monografias.com/trabajos5/acicar/acicar.shtml
http://www.educlas.cl/apuntes%20quimica/Acidos%20carboxilicos.pdf
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_acidos_carboxilicos.htm
Nombre: José Miguel Valdivia H.
Curso: 2º medio A
Fecha: viernes, 20 de abril.
Colegio: Santa Familia.